FEN7-KONU ANLATIM
BİLEŞİKLER VE FORMÜLLERİ|
Bileşikler ve Formülleri (Konu Anlatımı) |
|
Farklı elementlere ait atomların belirli oranlarda bir araya gelerek bağ yapmasıyla oluşan
|
|
Bileşiklerin Kimyasal Yolla Ayrıştırılması: |
|
|
|
|
Fiziksel ve Kimyasal Olaylar
Maddenin şekil, yoğunluk, çözünürlük, genleşme, erime ve kaynama noktaları, sıvı, katı ya da gaz hâlde olması gibi özellikleri maddenin fiziksel özellikleridir. Maddenin bu özelliklerinde görülen değişimlere fiziksel değişim veya fiziksel olay adı verilir. Fiziksel olaylarda maddenin
iç yapısında değişme olmaz. Örneğin demirin, tel levha veya çivi hâline getirilmesi fiziksel bir değişimdir. Bu olayda demirin şeklinde bir değişim olmuştur. Çivi de, tel de demirin özelliklerini taşır. Suyun donup buz olması ya da ısınıp buharlaşması da fiziksel bir değişmedir. Çünkü su, katı veya gaz hâle geçerken iç yapısında bir değişme olmamıştır. Su buharı soğutulduğunda tekrar su elde edilebilir. Buz da ısıtıldığında tekrar suya dönüşür.Demir, tel ya da çivi hâline getirilirken yapısında bir değişme olmaz. Fakat demir çivi paslandığında, artık demirin özelliklerini taşımaz. Bir odun baltayla ikiye kesilse odunun şeklinde bir değişme olur.Fakat odun yakıldığında geriye kalan kül, odunun özelliklerini taşımaz.
Yanma, paslanma, çürüme, ekşime, elektroliz gibi olaylar sonucunda maddenin iç yapısında değişmeler olur, yeni maddeler oluşur.
Maddenin iç yapısı, bileşimi, başka maddeye dönüşebilmesi gibi özelliklere kimyasal özellikler denir.Maddenin kimyasal özelliklerinde meydana gelen değişmeler sonucunda yeni özellikte maddeler oluşur. Kimyasal özelliklerdeki değişmelere kimyasal olay veya kimyasal tepkime adı verilir. Bileşik atomlarını bir arada tutan bağlara kimyasal bağ denir. Kimyasal değişmeler sırasında bu bağlar kopar, yenileri oluşur. Kimyasal olaylar, maddelerin birbirleriyle etkileşmesi sonucu oluşabileceği gibi ısı, elektrik akımı gibi dış etkilerle de oluşabilir.Örneğin demirin havadaki oksijenle birleşmesi sonucu pas oluşurken, suyun elektrik akımıyla elektrolizi sonucu hidrojen ve oksijen gazları açığa çıkar.
Kimyasal Tepkimeler
Kimyasal değişmelere ya da kimyasal tepkimelere kimyasal reaksiyonlar da denir.Kimyasal tepkime sırasında değişim geçiren
maddelere reaksiyona girenler, yeni oluşan maddelere de reaksiyondan çıkanlar ya da ürünler adı verilir.
Demirin paslanması sırasında havadaki oksijenle demir birleşerek demir oksit denilen pası oluşturur.Burada demir ve oksijen girenler, demir oksit ise çıkan üründür.
Kimyasal tepkimeler sırasında meydana gelen değişiklikler, kimyasal denklemlerle gösterilir.
Kimyasal denklemlerde giren ve çıkan maddeler formüllerle gösterilir.Örneğin kömür yanarken içindeki karbon havadaki oksijenle birleşir ve karbon dioksit gazı açığa çıkar. Bu olaya ilişkin tepkime denklemi şu şekilde yazılır:
C + O2 ----> CO2
Kömür Oksijen Karbon dioksit
Girenler Çıkanlar (Ürün)
Denklemden de görüldüğü gibi tepkimeye giren ve çıkan maddeler arasına ok konur. Giren maddeler okun sol tarafında, çıkanlar ise sağ tarafında bulunur.
Kimyasal denklemler tepkime hakkında bir çok bilgiyi basit bir şekilde göstermemize yarar. Örneğin; C + O2 ----> CO2 tepkimesi bize 1 karbon atomuyla 2 oksijen atomunun birleşerek 1 karbon dioksit molekülü oluşturduğunu gösterir.
Tepkime Çeşitleri
Kimyasal tepkimeler gerçekleşirken bazı maddeler arasında bağlar koparken, bazı maddeler arasında yeni bağlar oluşur.Kimyasal tepkimeler, oluş şekline göre sentez, ayrışma ve yer değiştirme tepkimeleri olarak sınıflandırılabilir:
1. Sentez (Birleşme) Tepkimeleri:
Element ya da bileşiklerin birleşmesiyle yeni bir madde oluşumuna sentez (birleşme) tepkimesi adı verilir.
Örnek; karbon dioksit ve suyun oluşumu:
C + O2 ----> CO2
2 H2 + O2 ---->2 H2O
2. Analiz (Ayrışma) Tepkimeleri:
Bir bileşik kendini oluşturan daha basit maddelere ayrışıyorsa, buna analiz (ayrışma)
tepkimesi adı verilir.
Örnek; suyun ve potasyum kloratın (KClO3) ayrışması:
2 H2O ---->2 H2 + O2
KClO3----> KCl + 3/2O2
3. Yer Değiştirme Tepkimeleri:
Bir element ve bir bileşik arasında ya da iki farklı bileşik arasında oluşan tepkimelerde,
atomlar birbiriyle yer değiştirip yeni bileşikler oluşturabilir. Bu tip tepkimelere
yer değiştirme tepkimesi adı verilir.
Örneğin magnezyum ile çinko oksit tepkimeye girdiğinde magnezyum oksit ve çinko oluşur.
Mg + ZnO ----> MgO + Zn
Tepkime denkleminde de görüldüğü gibi elementler yer değiştirerek yeni bileşikler oluşturur.
Tepkime Denklemlerinin Denkleştirilmesi
Kimyasal tepkimelere giren maddelerle çıkan maddeleri oluşturan atomların cinsleri ve sayıları aynıdır. Dolayısıyla bir tepkime denkleminin sol ve sağ tarafında aynı cins ve aynı sayıda atom bulunmalıdır.Böyle tepkime denklemlerine denkleştirilmiş
tepkime denklemi adı verilir.
Eğer bir tepkime denklemi denk değilse, formül ve sembollerin önüne uygun sayılar yazılarak tepkime denkleştirilir.
Örneğin su, oksijen ve hidrojenin birleşmesiyle oluşur. Fakat oksijen ve hidrojen tek atom hâlinde değil, O2 ve H2 molekülleri şeklinde ve gaz hâlde bulunur.Suyun tepkime denklemini
2 H2 + O2 ---->2 H2O şeklinde yazarsak denk bir tepkime denklemi yazmış olmayız.
Çünkü giren atom sayısı ile çıkan atom sayısı aynı değildir.
Girenler tarafında 2 tane O atomu, çıkanlar tarafında ise 1 tane O atomu vardır.
Denklemi denkleştirmek için H2 ve H2O’nun önüne 2 yazalım;
2 H2 + O2 ---->2 H2O
4 adet H 4 adet H
2 adet O 2 adet O
Bu durumda girenler ve çıkanlar denkleşmiş olur.Şimdi de O2’nin önüne 1/2 yazalım;
H2 + 1/2O2 ---->H2O
2 adet H 2 adet H
1 adet O 1 adet O
Görüldüğü gibi yine tepkimeye giren ve çıkan atom sayıları denkleşti.
O hâlde, denk olmayan bir kimyasal tepkime denklemi, formüllerin
başlarına katsayılar yazılarak denk hâle getirilebilir.
Örnek:Magnezyum ve oksijen birleşerek Magnezyum oksit (MgO) bileşiğini oluşturur.
Bu olayın tepkime denklemini yazınız.
Örnek: Metanın formülü CH4 olduğuna göre, metan ve oksijen arasındaki kimyasal denklemi yazınız.
Tepkimelerde Kütlenin Korunumu
Bir kimyasal tepkimede, tepkimeye giren maddelerin kütlelerinin toplamı, çıkan maddelerin kütlelerinin toplamına eşittir.Demirin kükürt ile tepkimesinden demir sülfür oluşur
(Kükürt = Sülfür). Demir sülfürün tepkime denklemi şu şekildedir.
Fe + S ---->FeS
56 32 88 g
Giren Çıkan
kütle = 56 + 32 = 88 g kütle = 88 g
Örnek: Kalsiyum karbonat ısıtıldığında kalsiyum oksit ve karbon dioksit maddelerine ayrışır.
100 g kalsiyum karbonat ayrıştığında 44 g karbon dioksit çıktığına göre, kaç gram
kalsiyum oksit oluşur?
Birden çok maddenin kimyasal bağ oluşturma-dan bir arada bulunmasıyla meydana gelen mad-delere karışım denir.
Karışımlar görünümlerine göre iki çeşittir:
1-Heterojen Karışımlar (Adi Karışımlar): Karışımı oluşturan maddeler karışımın her tarafına eşit miktarlarda dağılmaz.
Örnek: (tebeşir tozu+ su), (zeytinyağ+su)
Süt, ayran, toprak, beton, sis….
A- Süspansiyon (katı- sıvı)
Bir katının sıvı içerisinde çözünmeyip, parçacıklar (asılı)halinde kalmasıyla oluşan karışımlardır. Ör-nek: ayran, pişmiş türk kahvesi, çamurlu su, te-beşirli su, hoşaf, taze sıkılmış meyve suyu, kan.
B- Emülsiyon (sıvı- sıvı)
Bir sıvının başka bir sıvı içerisinde çözünmeden kalmasıyla oluşan karışımlardır. Örnek: zeytinyağ-su, benzin-su, süt…
C- Aerosol (sıvı- gaz)
Bir sıvının gaz ile oluşturduğu heterojen karışım-lardır. Örnek: deodorantlar, sis, spreyler…
Heterojen Karışımların Özellikleri:
1- Heterojen özellik gösterirler.
2- Bulanık görünürler.
3- Dipte çökelti oluştururlar.
4- Genellikle tanecikleri gözle görülür.
5- Fiziksel yolla (süzme) ayrılırlar.
2-Homojen Karışımlar (Çözeltiler): Karışımı oluşturan maddeler, karışımın her tarafına eşit olarak dağılmışlardır.
Örnek: bronz, çelik, sirke, hava, tuzlusu
Çözeltiler fiziksel hallerine bağlı olarak katı, sıvı veya gaz halde bulunabilirler.
A- Katı-Katı çözeltiler:
Alaşımlar =metal+metal
B- Sıvı çözeltiler:
Sıvı- Katı: burun damlası, şerbet
Sıvı- Sıvı: kolonya, sirke
Sıvı- Gaz: gazoz, deniz suyu
C- Gaz çözeltiler:
Gaz- gaz çözeltiler= hava, doğalgaz...
Homojen Karışımların Özellikleri
1- Homojendirler
2- Dipte çökelti oluşturmazlar.
3- Berrak görünüşlüdürler.
4- Tanecikleri gözle görülmez.
5- Süzme ile ayrılmazlar.
6- Belirli erime, kaynama noktaları yoktur. Çözünen madde miktarı arttıkça kaynama nok. yükselir, donma nok. azalır.
ÇÖZELTİLER (HOMOJEN KARIŞIMLAR)
Çözeltiler iki kısımdan oluşur:
Çözücü madde Çözünen madde
(katı,sıvı,gaz (sıvıdır: su, alkol, eter, olabilir.) tiner, benzin vb.)
Su + Tuz………..Tuzlusu
Çözen ve çözünen madde miktarına göre çözeltiler :
1- Seyreltik Çözelti: Bir başka çözeltiye göre; Çözünen madde miktarı az, çözen madde miktarı ( çözücü) fazla olan çözeltilerdir.
(Ör: 100gr su+ 1 gr şeker çözeltisi, 100gr su+ 10 gr şeker çözeltisine göre seyreltiktir.)
2-Derişik Çözelti: Bir başka çözeltiye göre; Çözünen madde miktarı fazla, çözücüsü az olan çözeltilerdir.
(Ör: 100gr su+ 15 gr şeker çözeltisi, 100gr su+ 5 gr şeker çözeltisine göre derişiktir.)
Seyreltik çözeltiler derişik hale getirilebilir. Bu-nun için:
Çözücü (sıvı) buharlaştırılır
Çözünen eklenir
Çözelti soğutulur
Derişik çözeltileri seyreltik hale getirmek için;
Çözücü eklenir.
Çözünebilen madde miktarına göre çözeltiler:
1- Doymuş Çözelti: Belli bir sıcaklıkta çözebileceği kadar çözüneni içeren çözeltilerdir.
2- Doymamış Çözelti: Belli bir sıcaklıkta, çözebileceğinden daha az çözünen içeren çözeltilerdir.
3- Aşırı Doymuş Çözelti: Çözebileceğinden da-ha fazla madde bulunduran çözeltilerdir.(heterojen görünürler.)
Elektrik akımını iletmelerine göre çözeltiler:
1-İletken (elektrolit) Çözeltiler: İçerisinde + ve -- yüklü iyon bulunduran çözeltiler elektrik akımını iletir. Ör: sirkeli, asitli, tuzlu, limonlu su
2- İletken olmayan ( Elektrolit olmayan) Çözelti: İçerisinde moleküller bulunur. İyon
yoktur. Bu yüzden iletken değildir. Ör: alkollü su, şekerli su, üre, kolonyalı su, safsu.)
ÇÖZÜNÜRLÜK
Belli sıcaklıkta ve basınçta 100gr çözücü içinde çözünebilen maksimum madde miktarına çözünürlük denir. Çözünürlük, katı, sıvı, gaz maddeler için ayırt edici bir özelliktir.
Çözünürlüğe Etki Eden Faktörler:
1- Basınç: Gazların çözünürlüğü basınç arttıkça artar. Basınç, katı ve sıvılarda çözünürlüğe etki etmez.
2- Sıcaklık: Katı ve sıvılarda çözünürlük, sıcaklıkla doğru orantılıdır. Gazlarda ters orantılıdır.Örneğin Karadeniz de oksijen miktarı akdenizden daha çoktur.çünkü deniz suyu soğuktur.
3- Çözücü türü: Örneğin tuz suda çözünürken, yağda çözünmez. Şeker suda çözünürken, alkolde çözün-mez.
Çözünürlük Hızına etki Eden Faktörler: Çözünürlük hızı;
1- Sıcaklık: Sıcaklıkla doğru orantılıdır.
2- Çözünenin temas yüzeyini artırırsak artar.
3- Karıştırma, çalkalama ile doğru orantılıdır.
4- Çözünen cinsi (Tuz ve şeker su içinde farklı hızlarda çözünür.)
Çözünürlük= Madde miktarı/100 ml
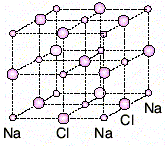
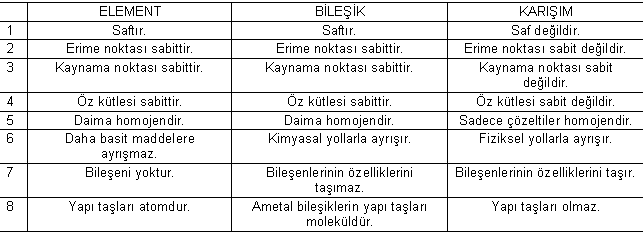
ELEMENT, BİLEŞİK VE KARIŞIMLARIN KARŞILAŞTIRILMASI
ELEMENT
Saf maddelerdir.
Kendine özgü öz kütlesi vardır.
Fiziksel veya kimyasal yöntemlerle basit maddelere ayrışmaz.
Homojendir.
Kendilerine özgü E.N, K.N vardır.
Yapıtaşı atomdur.
Aynı cins atomlardan oluşur.
Sembolle gösterilir.
BİLEŞİK
Saf maddelerdir.
Kendine özgü öz kütlesi vardır.
Kimyasal yöntemlerle ayrışır. (elektroliz, ısıtma)
Homojendir.
Kendilerine özgü E.N, K.N vardır.
Yapıtaşı moleküldür.
Farklı cins atom, aynı cins moleküllerden oluşur.
Formüllerle gösterilir.
Elementlerin sabit oranlarda birleşmesiyle oluşur.
Elementler özelliklerini kaybeder.
KARIŞIM
Saf değillerdir.
Sabit öz kütlesi yoktur.
Fiziksel yöntemlerle ayrışır. (süzme, eleme,damıtma)
Homojen veya heterojendir.
EN, KN belirgin değildir.
Yapıtaşı atom veya molekül-dür.
Farklı cins atom ve moleküller-den oluşur.
Belli formülleri yoktur.
Karışımı oluşturan maddeler arasında belirli oran yoktur. Her oranda karışabilirler.
Karışımı oluşturan maddeler özelliklerini kaybetmezler.
IŞIK BİR ENERJİ TÜRÜDÜR
Görme olayı ışıkla gerçekleşir. Cisme gelen ışık, cisimden yansıyarak göze gelirse cisim görünür.
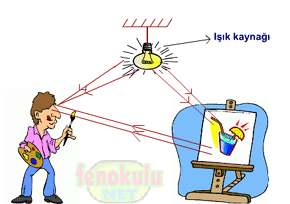
Ama bu cisim bir ışık kaynağı ise, hangi ortamda olursa olsun, çevresine ışık verdiğinden karanlıkta olsa da görülür. Işığın yayılması için ortam gerekmez; ışık, boşlukta da yayılır. Işık kaynağından çıkan ışık ışınları, homojen ve saydam ortamda ise doğrular halinde yayılır.
Maddeler üzerlerine düşen ışığı yansıtıp yansıtmamalarına göre üçe ayrılır: Üzerine düşen
ışığı geçirebilen maddelere saydam maddeler denir. Ör: Cam, su, hava….
Üzerine düşen ışığın bir kısmını geçirebilen maddeler yarı saydam maddeler denir.
Ör: Yağlı kâğıt, buzlu cam..
Üzerine düşen ışığı hiç geçirmeyen maddelere ise opak ( saydam olmayan) maddeler denir.
Işık Bir Enerjidir: Metal bir çubuk ısıtılınca önce kızarır ve zayıf bir ışık yayar. Isıtılmaya devam edilirse akkor haline gelir. Bu olayda ısı enerjisinin bir kısmı ışığa dönüşmektedir. Işığın bir enerji olduğunu kanıtlayan bir başka olay da Dünyaya ısı ve ışık olarak ulaşan güneş
enerjisidir. Güneş ışığı hesap makineleri, uzay araçları, tekneler gibi birçok sistemin çalışmasında enerji kaynağı olarak kullanılmaktadır.
Işık enerjisi ; radyometre cihazı ile hareket ,güneş pili ile elektrik ,güneş panelleri ile ısı ,enerjilerine dönüştürülebilir.
Işık Kaynakları: Işık kaynakları sıcak ve soğuk olmak üzere ikiye ayrılır. Güneş, ampul,
mum gibi kaynaklar sıcak, floresan, lamba, ateş böceği gibi kaynaklar soğuk ışık kaynaklarıdır. Sıcak ışık kaynakları çevresini ısıtır. Güneşten dünyaya gelen ışık, üzerine düştüğü maddeye enerjisini aktarır. Işık, madde ile etkileşmesi sonucu soğurulabilir.
Soğurulma, ışığın madde tarafından emilmesi olduğu için soğurulan ışık enerjisi ile
madde ısınır. Isınan maddenin ise sıcaklığı artar.(Soğurma: Maddelerin ışığı tutup, ısıya dönüştürmesine denir.) Koyu renkli cisimler, üzerlerine düşen ışığın büyük bir kısmını soğururlar. Açık renkli cisimler ise üzerlerine düşen ışığın büyük bir kısmını yansıtır, az bir kısmını soğururlar. Bu yüzden koyu renkler, açık renklerden daha çabuk ısınır.
RENKLER
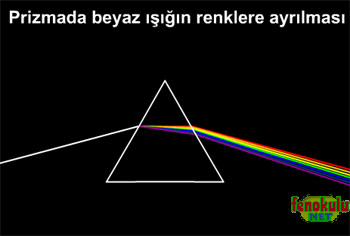
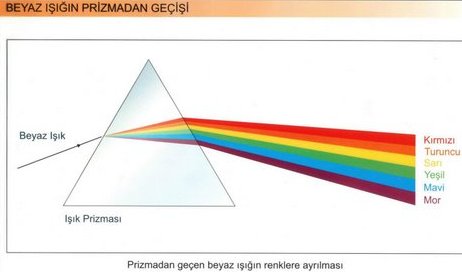
Güneşten bize ulaşan beyaz ışık, gerçekte birçok rengin bileşiminden oluşur.
Beyaz aslında başlı başına bir renk değil, bütün renklerin bileşiminden oluşur.
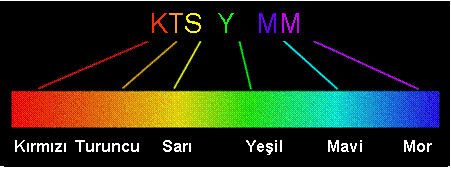
Güneş ışığını bir prizmadan geçirdiğimizde renklerine ayrıldığını ve bu renklerin de
sırası ile kırmızı, turuncu, sarı, yeşil, mavi ve mor olduğunu biliyoruz.
Cisimler güneş ışığı ile aydınlatıldığında, üzerine bu renklerin karışımı olan ışık
düştüğünden, cisimler bunlardan bir kısmını yansıtırlar ve sonuçta değişik renklerde
cisimler olarak algılanır. Bir cisim;
• Güneş ışığındaki tüm renkleri yansıtıyorsa beyaz
• Güneş ışığındaki hiçbir rengi yansıtmıyorsa siyah
• Güneş ışığındaki herhangi bir rengi yansıtıyorsa, o renkte görünür.
Güneş ışığındaki renklerden kırmızı, mavi ve yeşil renge ana renk denir. Bu üç ışığın tek tek ya da değişik oranlardaki karışımı göze gelirse, göz, cisimleri bu karışımlara göre değişik renklerde algılar. Bu üç rengin, karışımları beyaz ışığı verir. Şekilde bu durum görülmektedir. Aynı tabloyu incelersek kırmızı ve yeşil ışık göze gelirse sarı, kırmızı ve mavi ışık göze gelirse magenta, mavi ve yeşil ışık göze gelirse cyan olarak algılanır.
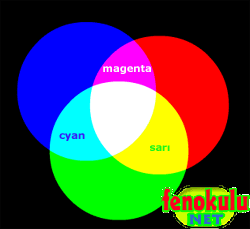
Cisimlerin Işığı Yansıtması
Bir cisim güneş ışığındaki tüm renkleri yansıtıyorsa beyaz görünür.
Buradan anlıyoruz ki beyaz cisimler bütün renkleri yansıtıyor.
Beyaz cisim, beyaz ışıkla aydınlatılırsa beyaz,
kırmızı ışıkla aydınlatılırsa kırmızı, mavi ışıkla aydınlatılırsa mavi görünür.
Dolayısıyla beyaz cisimler hangi ışıkla aydınlatılırsa o renkte algılanırlar.
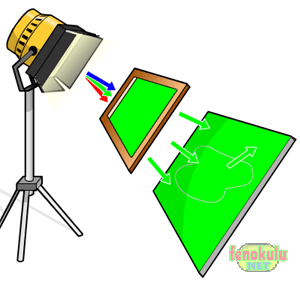
Örnek olarak aşağıda beyaz ışık yeşil bir filtreden geçirilmiştir.
Filtreden sadece yeşil ışık geçebilmiştir. Yeşil bir cismin üzerine düşen
yeşil renk ile cisim yine yeşil olarak gözükmüş veya yeşil rengi cisim yansıtmıştır.
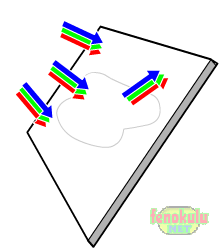
Eğer cisim, hiçbir rengi yansıtmıyorsa siyah görünür. Yani siyah cisimler hiçbir
rengi yansıtmaz, üzerine düşen tüm renk ışınları yutar, soğurur.
Eğer cisim, tüm renkleri yansıtıyorsa aşağıda görüldüğü gibi beyaz görünür.
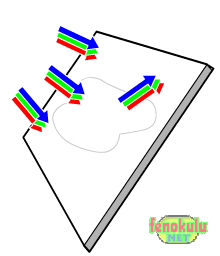
Eğer mavi kitabı yeşil ışık altında aydınlatırsak, yeşil, mavinin komşusu olduğundan
zayıf olarak yansır. Fakat bu zayıf ışık, gözü yeşil renkte uyaramayacağından, mavi kitap
siyah görünür.
Aşağıda mavi bir cisme beyaz bir ışık gönderir isek bu cisim sadece mavi rengi yansıyacaktır.
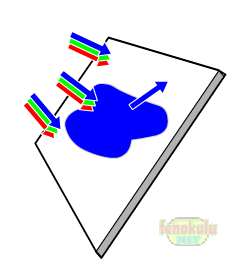
Işığın Filtrelerden Geçişi
Saydam cisimler, üzerlerine gelen ışığı geçirme özelliğine sahiptir. Adi cam, üzerine
gelen ışığı tamamen geçirir. Ama bazı camlar renkli olabilir.
Işığı geçirebilen renkli, saydam cisimlere filtre denir. Örneğin güneş gözlükleri birer filtredir. Filtreler, üzerlerine düşürülen ışıktan, kendi renklerini kuvvetli, komşu renklerini zayıf olarak geçirirler. Yani kırmızı filtre, kırmızı ışığı güçlü, turuncu ışığı zayıf geçirir. Mavi filtre, mavi ışığı güçlü, yeşil ve mor ışığı zayıf geçirir. Sarı filtre, sarı ışığı kırmızı ışığı, yeşil ışığı güçlü, mavi ışığı ise zayıf geçirir.
Şekilde kırmızı filtreden kırmızı ışık güçlü, turuncu ışık ise zayıf geçer. Bu kırmızı filtreden
geçen kırmızı ve zayıf turuncuda ışınlarıda mavi filtreden geçemez, mavi filtre siyah görünür.
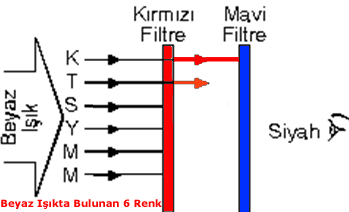
IŞIK TAYFI - IŞIK TÜRLERİ- ELEKTROMANYETİK TAYF
Çevremizdeki cisimleri, görünür ışığın yansıyarak gözümüze gelmesi sayesinde görürüz.
Yazın, zararlı ışınlardan korunmak için, güneş gözlüğü takar, plajda güneşlenirken
güneş kremi süreriz. Tüm bunlar ise, gözle görülmeyen ışık türlerinden korunmak içindir.
Işık dalgalar halinde, boşlukta da yayılabilen bir enerji türüdür. Işık, bir elektromanyetik bir ışınımdır. Enerjinin elektromanyetik dalgalar halinde yayılmasına radyasyon (ışınım) denir.
Bir elementin en küçük birimi nasıl atomsa, elektromanyetik radyasyonların da en küçük birimi fotondur. Fotonların kütleleri yoktur ve boşlukta ışık hızında enerji paketleri şeklinde yayılırlar.
Elektromanyetik dalgalar, sahip oldukları enerji büyükten küçüğe doğru olacak şekilde:
1- Gama Işını, 2- X ışını, 3- Ultraviyole ( mör ötesi ) Işınlar, 4- Görünür Işık, 5- Kızılötesi Işık,
6- Mikrodalga Işınlar 7- Radyo Dalgaları
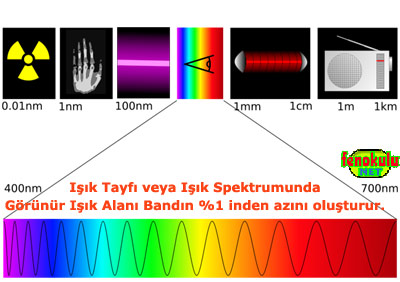
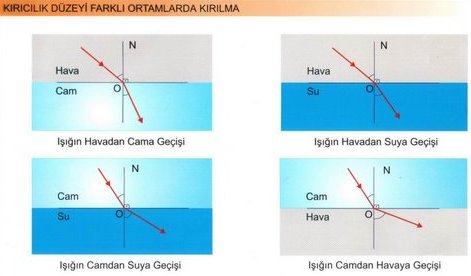
IŞIĞIN KIRILMASI
|
Işığın Kırılması (Konu Anlatım) |
|
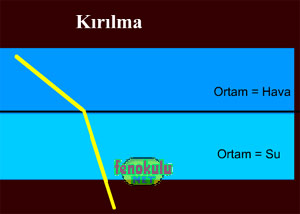
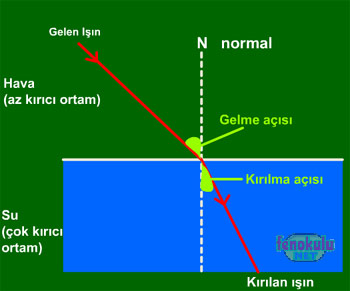
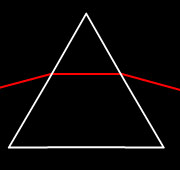
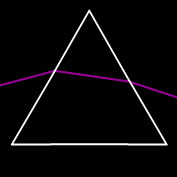
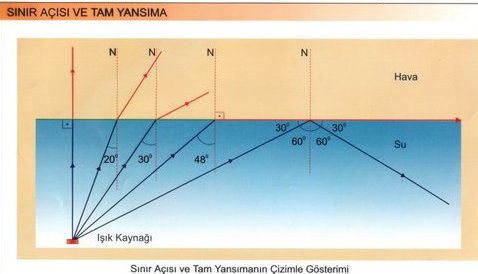
Işık ışınları saydam bir ortamdan başka bir saydam ortama geçerken ışınların bir kısmı yansıyarak geldiği ortama dönerken, bir kısmı da ikinci ortama, doğrultusu ve hızı değişerek geçer. Işığın ikinci ortama geçerken doğrultu değiştirmesine ışığın kırılması denir.
Günlük hayatınızda kırılma olayın su dolu bardağa koyduğumuz bir kalemin görüntüsündeki kırılmada net olarak görebiliriz.
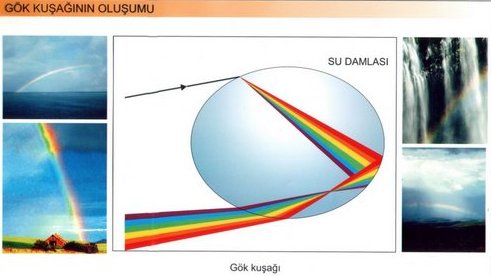
Gök Kuşağı Nasıl oluşur?
Yağmur damlasının içine girince kırmızı, turuncu, sarı, yeşil, mavi, lacivert ve
|